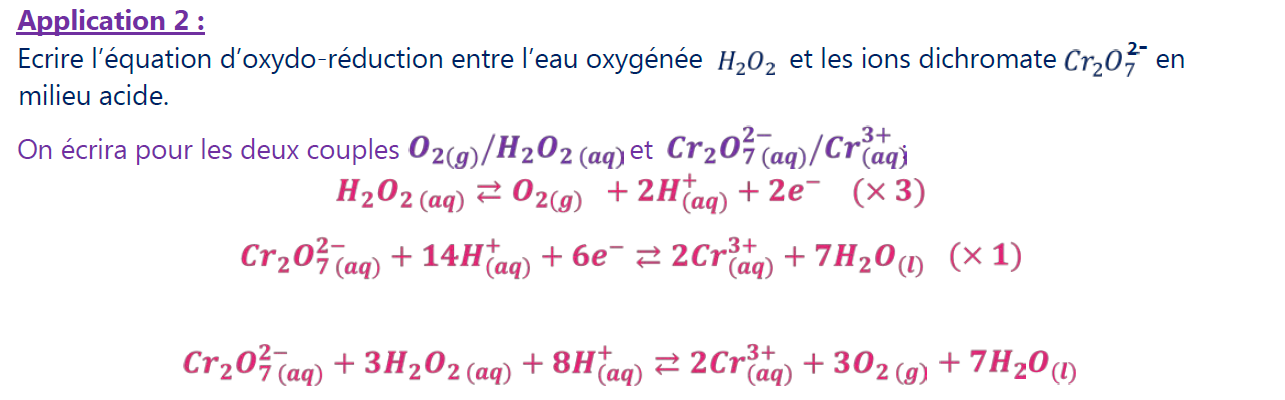LES REACTIONS D’OXYDOREDUCTION.
Introduction :
I. Réaction d’oxydo-réduction.
1-Transfert électronique:
Expérience et observation:
On immerge une plaque de zinc dans une solution de sulfate de cuivre(II).

On observe un dépôt rouge de cuivre et la décoloration de la solution.
L’addition de la soude fait apparaitre un précipité blanc ce qui implique la présence des ions $\mathrm{Zn}^{2+}$ dans la solution.
L’équation de la réaction peut alors s’écrire:
$$
Z n_{(s)}+C u_{(a q)}^{2+} \rightleftarrows Z n_{(a q)}^{2+}+C u_{(s)}
$$
Chaque atome de zinc se transforme en ion zinc par perte de deux électrons, On écrira :
$$
Z n_{(s)} \rightleftarrows Z n_{(a q)}^{2+}+2 e^{-}$$
L’ion cuivrell capte deux électrons pour se transformer en atome $C u$, on écrira :
$$
C u_{(a q)}^{2+}+2 e^{-} \rightleftarrows C u_{(s)}
$$
Au cours de cette réaction il y’a transfert d’électrons entre l’atome de zinc et l’ion cuivrelI.
Il caractérise une réaction d’oxydo-réduction.
2- Définitions:
2.1- Oxydation et réduction:
Une oxydation est une réaction chimique au cours de laquelle une espèce chimique un oxydant gagne un ou plusieurs électrons.
Une réduction est une réaction chimique au cours de laquelle une espèce chimique un réducteur perd un ou plusieurs électrons.
2.2- Un oxydant et un réducteur:
Un oxydant est une espèce chimique susceptible de capter un ou plusieurs électron(s).
Un réducteur est une espèce chimique susceptible de perdre un ou plusieurs électron(s).
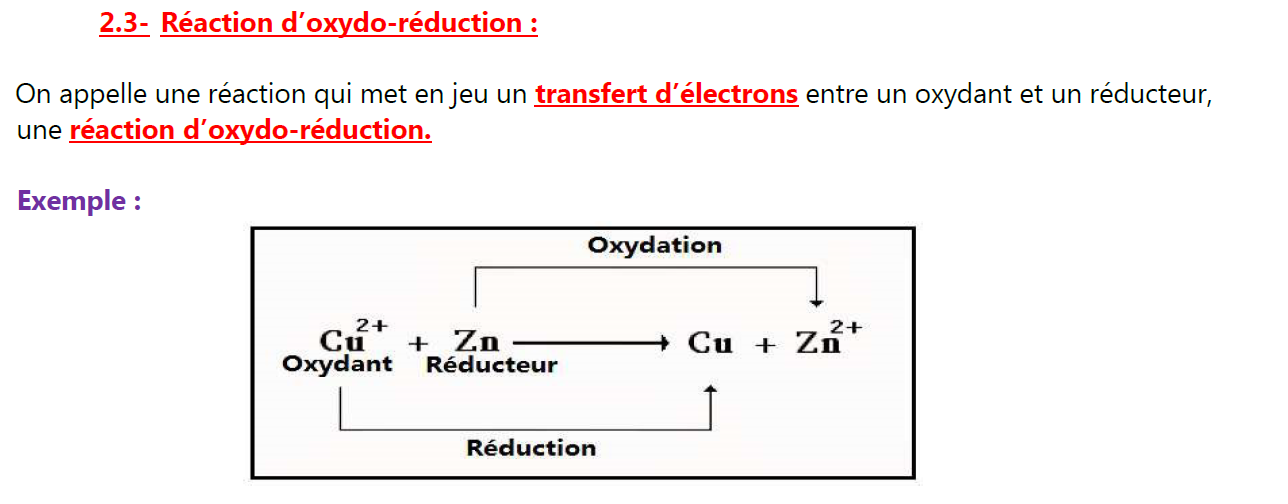
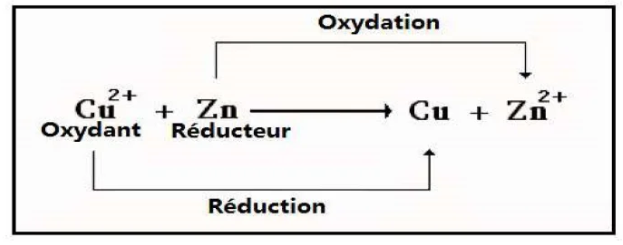
2.3- Réaction d’oxydo-réduction:
On appelle une réaction qui met en jeu un transfert d’électrons entre un oxydant et un réducteur, une réaction d’oxydo-réduction.
II. Couple oxydant / réducteur.
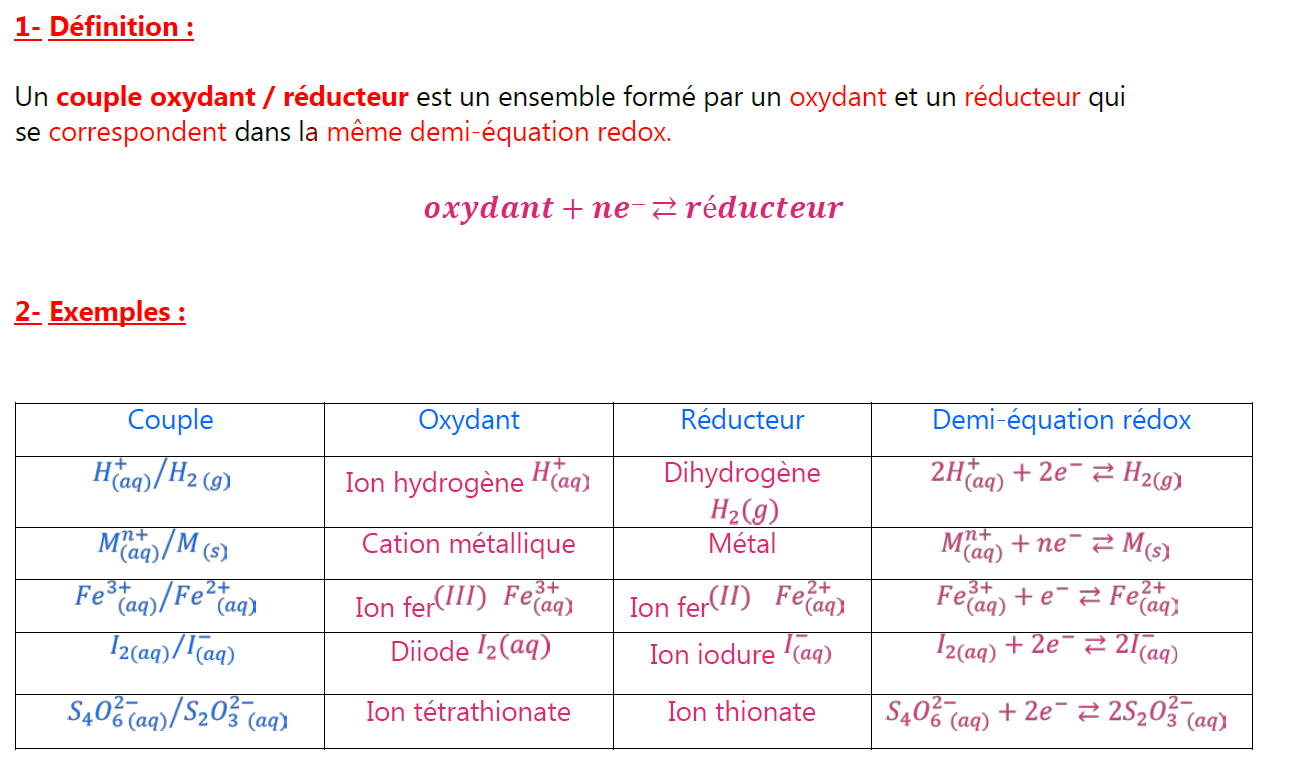
1-Définition:
Un couple oxydant / réducteur est un ensemble formé par un oxydant et un réducteur qui se correspondent dans la même demi-équation redox.
$$
\text { oxydant }+n e^{-} \rightleftarrows \text { réducteur }
$$
2-Exemples:
CoupleCoupleCoupleCouple
| Couple | Oxydant | Réducteur | Demi-équation rédox |
| $H_{(a q)}^{+} / H_{2(g)}$ | Ion hydrogène $H_{(a q)}^{+}$ | Dihydrogène $$ | $2 H_{(a q)}^{+}+2 e^{-} \rightleftarrows H_{2(g)}$ |
| $M_{(a q)}^{n+1} / M_{(s)}$ | Cation métallique | Métal | $M_{(a q)}^{n+}+n e^{-} \rightleftarrows M_{(s)}$ |
| $F e_{(a q)}^{3+} / F e_{(a q)}^{2+}$ | Ion fer ${ }^{(I I I)} F e_{(a q)}^{3+}$ | Ion fer ${ }^{(I I)} \quad \mathrm{Fe}_{(a q)}^{2+}$ | $\mathrm{Fe}_{(a q)}^{3+}+e^{-} \rightleftarrows \mathrm{Fe}_{(a q)}^{2+}$ |
| $I_{2(a q)} / I_{(a q)}^{-}$ | Diiode $I_2(a q)$ | Ion iodure $I_{(a q)}^{-}$ | $I_{2(a q)}+2 e^{-} \rightleftarrows 2 I_{(a q)}^{-}$ |
| $\mathrm{S}_4 \mathrm{O}_{6(a q)}^{2-} / S_2 \mathrm{O}_3^{2-}(a q)$ | Ion tétrathionate | Ion thionate | $\mathrm{S}_4 \mathrm{O}_{6(a q)}^{2-}+2 e^{-} \rightleftarrows 2 \mathrm{~S}_2 \mathrm{O}_{3(a q)}^{2-}$ |
III. Réaction d’oxydo-réduction.
1- Demi-équation d’oxydo-réduction:
L’écriture des demi-équations redox est basée sur les lois de conservation des éléments et des charges électriques.
Premier exemple:
$$
\mathrm{Fe}_{(a q)}^{3+}+e^{-} \rightleftarrows F e_{(a q)}^{2+}
$$
La conservation de la charge électrique est assurée par les électrons
Deuxième exemple:
On considère le couple $\mathrm{MnO}_{4(a q)}^{-} / \mathrm{Mn}_{\text {(aq) }}^{2+}$
$$
\mathrm{MnO}_{4(a q)}^{-}+8 \mathrm{H}_{(a q)}^{+}+5 e^{-} \rightleftarrows \mathrm{Mn}_{(a q)}^{2+}+4 \mathrm{H}_2 \mathrm{O}_{(l)}
$$
La conservation de l’élement O est assurée par les molécules $\mathrm{H}_2 \mathrm{O}$ et celle de l’élément H par les ions $\mathrm{H}^{+}$.
2- Les réactions d’oxydo-réduction:
Une réaction d’oxydo-réduction met en jeu deux couples redox. Elle consiste en un transfert d’un ou plusieurs électron(s) du réducteur de l’un des couples à l’oxydant de l’autre couple.
Les électrons n’apparaissent pas dans l’équation de la réaction.
On écrira pour les deux couples $O x_1 / r$ ré $d_1$ et $O x_2 / r$ ré $d_2$ :
Demi-équation électronique :
$$
réd_1 \rightleftarrows O x_1+n_1 e^{-} \quad \times n_2
$$
Demi-équation électronique :
$$
\boldsymbol{O} x_2+n_2\boldsymbol{e}^{-} \quad \rightleftarrows \quad \text { ré } d_2 \quad \times n_1
$$
Equation bilan :
$$
n_2réd_1+n_1 o x_2 \rightarrow n_2 o x_1+n_1 r \text { ré } d_2
$$
Application 1:
Ecrire l’équation d’oxydo-réduction entre les ions $\mathrm{fer}(I I)$ et les ions permanganate $\mathrm{MnO}_4^{-}$en milieu acide.
On écrira pour les deux couples $\boldsymbol{F e}_{(a q)}^{3+} / \mathbf{F e}_{(a q)}^{2+}{ }^{2+} \mathbf{M n O}_{4(a q)}^{-} / \mathbf{M n}_{(a q)}^{2+}$ :
$$
\begin{gathered}
\mathrm{Fe}_{(a q)}^{2+} \rightleftarrows \mathrm{Fe}_{(a q)}^{3+}+e^{-}(\times 5) \\
\mathrm{MnO}_{4(a q)}^{-}+8 \mathrm{H}_{(a q)}^{+}+5 e^{-} \rightleftarrows \mathrm{Mn}_{(a q)}^{2+}+4 \mathrm{H}_2 \mathrm{o}_{(t)}(\times 1)
\end{gathered}
$$
Application 2:
Ecrire l’équation d’oxydo-réduction entre l’eau oxygénée $\mathrm{H}_2 \mathrm{O}_2$ et les ions dichromate $\mathrm{Cr}_2 \mathrm{O}_7^{2-}$ en milieu acide.
On écrira pour les deux couples $\mathrm{O}_{2(g)} / \mathrm{H}_2 \mathrm{O}_{2(a q)}$ et $\mathrm{Cr}_2 \mathrm{O}_{7(a q)}^{2-} / \mathrm{Cr}_{(a q)}^{3+}$
$$
\begin{gathered}
\mathrm{H}_2 \mathrm{O}_{2(a q)} \rightleftarrows \mathrm{O}_{2(g)}+2 \mathrm{H}_{(a q)}^{+}+2 e^{-}(\times 3) \\
\mathrm{Cr}_2 \mathrm{O}_{7(a q)}^{2-}+14 \mathrm{H}_{(a q)}^{+}+6 e^{-} \rightleftarrows 2 \mathrm{Cr}_{(a q)}^{3+}+7 \mathrm{H}_2 \mathrm{O}_{(l)}(\times 1) \\
\mathrm{Cr}_2 \mathrm{O}_{7(a q)}^{2-}+3 \mathrm{H}_2 \mathrm{O}_{2(a q)}+8 \mathrm{H}_{(a q)}^{+} \rightleftarrows 2 \mathrm{Cr}_{(a q)}^{3+}+3 \mathrm{O}_{2(g)}+7 \mathrm{H}_2 \mathrm{O}_{(l)}
\end{gathered}
$$