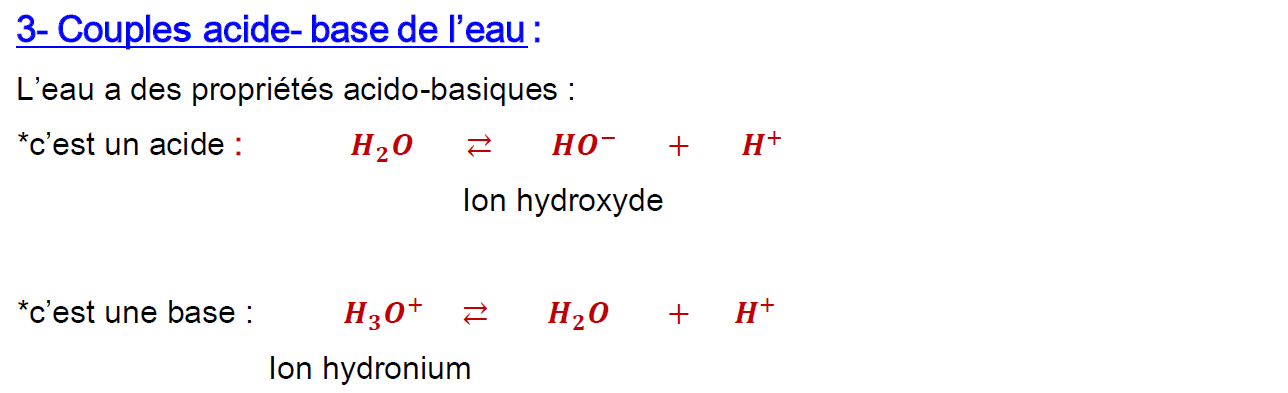LES REACTIONS ACIDO-BASIQUES.
Introduction :
I. Notion d’acide et de base selon Bronsted.
1- Exemple de réaction acido-basique:
* Réaction entre l’acide nitrique et l’eau:
La réaction entre l’acide nitrique $\mathrm{HNO}_3$ et l’eau produit des ions nitrate $\mathrm{NO}_3^{-}$et des ions oxonium $\mathrm{H}_3 \mathrm{O}^{+}$selon la réaction suivante :
$$
\mathrm{HNO}_{3(l)}+\mathrm{H}_2 \mathrm{O}_{(l)} \rightarrow \mathrm{NO}_{3(a q)}^{-}+\mathrm{H}_3 O_{(a q)}^{+}
$$
* On constate au cours de cette réaction que l’espèce chimique $\mathrm{HNO}_3$ a perdu un proton $\mathrm{H}^{+}$alors que l’espèce $\mathrm{H}_2 \mathrm{O}$ a gagné ce proton.
$*$ Définition:
Une réaction d’acido-basique est caractérisée par un transfert de proton $H^{+}$entre un acide est une base.
2-Définition de l’acide et de la base selon Bronsted
On appelle acide une espèce chimique capable de céder un ou plusieurs protons $\mathrm{H}^{+}$ au cours d’une transformation chimique.
Exemples:
$$
\mathrm{H}_2 \mathrm{O} ; \mathrm{H}_3 \mathrm{O}^{+} ; \mathrm{NH}_4^{+} ; \mathrm{HCOOH} .
$$
On appelle base une espèce chimique capable de capter un ou plusieurs protons $\mathrm{H}^{+}$ au cours d’une transformation chimique.
Exemples:
$$
\mathrm{HO}^{-} ; \mathrm{H}_2 \mathrm{O} ; \mathrm{NH}_3 ; \mathrm{HCOO}^{-}
$$
II. Couples acide / base
1-Définition:
Deux espèces chimiques constituent un couple acide / base s’il est possible de passer de l’un à l’autre par perte ou gain d’un proton $H^{+}$.
Exemples:
acide/base $\quad \mathrm{NH}_4^{+} / \mathrm{NH}_3 \quad ; \quad \mathrm{H}_2 \mathrm{O} / \mathrm{HO}^{-} ; \mathrm{H}_3 \mathrm{O}^{+} / \mathrm{H}_2 \mathrm{O}$
2-Demi-équation acido-basique:
Soit $A H / A^{-}$un couple acide/base.
Si $A H$ est l’un des réactifs il va donner sa base conjuguée : $A H \rightarrow A^{-}+H^{+}$
Si $A^{-}$est l’un des réactifs il va donner son acide conjugué : $A^{-}+H^{+} \rightarrow A H$
La demi-équation du coupleacide/base $A H / A^{-}$s’écrit :
$$
A H \rightleftarrows A^{-}+H^{+}
$$
Exemple:
$$
\underset{\text { ion ammonium }}{\mathrm{NH}_4^{+}} \rightleftarrows \underset{\text { ammoniac }}{ } \underset{\mathrm{NH}_3}{ }+\mathrm{H}^{+}
$$
3-Couples acide-base de l’eau:
L’eau a des propriétés acido-basiques :
*c’est un acide : $\quad \mathrm{H}_2 \mathrm{O} \rightleftarrows \mathrm{HO}^{-}+\mathrm{H}^{+}$
Ion hydroxyde
*c’est une base : $\quad \mathrm{H}_3 \mathrm{O}^{+} \rightleftarrows \mathrm{H}_2 \mathrm{O}+\mathrm{H}^{+}$
Ion hydronium
4- Notion d’ampholyte:
L’eau se comporte comme un acide dans le couple $\mathrm{H}_2 \mathrm{O} / \mathrm{HO}^{-}$et comme une base dans le couple $\mathrm{H}_3 \mathrm{O}^{+} / \mathrm{H}_2 \mathrm{O}$, on l’appelle ampholyte (ou amphotère).
III. L’équation chimique d’une réaction acido-basique.
Si l’acide $A_1 H$ réagit avec la base $A_2^{-}$, On écrit directement les demi-équations dans le sens où elles se produisent.
$$
\begin{aligned}
& A_1 H \rightleftarrows A_1^{-}+H^{+} \\
& A_2^{-}+H^{+} \rightleftarrows A_2 H
\end{aligned}
$$
La combinaison de ces 2 demi-équations donne l’équation de la réaction :
$$
A_1 H+A_2^{-} \rightleftarrows A_1^{-}+A_2 H
$$
Application :
1- Ecrire les demi-équations de réactions acido-basiques relatives à :
a- L’acide nitreux $\mathrm{HNO}_{2(a q)}$
b- L’ammoniac $\mathrm{NH}_{3(a q)}$
2- En déduire l’équation de la réaction entre l’acide nitreux et l’ammonic.
Réponse
$1-$
a- Acide nitreux :
$$
\begin{gathered}
\mathrm{HNO}_2 \rightleftarrows \mathrm{NO}_2^{-}+\mathrm{H}^{+} \\
\mathrm{NH}_3+\mathrm{H}^{+} \rightleftarrows \mathrm{NH}_4^{+}
\end{gathered}
$$
b- Ammonic :
2- Equation de la réaction :
$$
\mathrm{HNO}_{2(a q)}+\mathrm{NH}_{3(a q)} \rightleftarrows \mathrm{NO}_{2(a q)}^{-}+\mathrm{NH}_{4(a q)}^{+}
$$
IV. Les indicateurs colorés acido-basiques .
Un indicateur coloré est un couple acide-base dont l’acide HInd et la base Ind ${ }^{-}$n’ont pas la même couleur. Son couple est noté : HInd/Ind ${ }^{-}$.
En présence de l’acide HA, la base de l’indicateur réagit selon la réaction:
$$
\mathrm{Ind}^{-}+\mathrm{HA} \rightarrow \mathrm{HInd}+\mathrm{A}^{-}
$$
Le mélange prend la couleur de l’espèce acide HInd.
En présence de la base $A^{-}$, l’acide de l’indicateur réagit selon la réaction:
$$
\mathrm{HInd}+\mathrm{A}^{-} \rightarrow \mathrm{Ind}^{-}+\mathrm{HA}
$$
Le mélange prend la couleur de l’espèce basique $\underline{I n d^{-}}$.
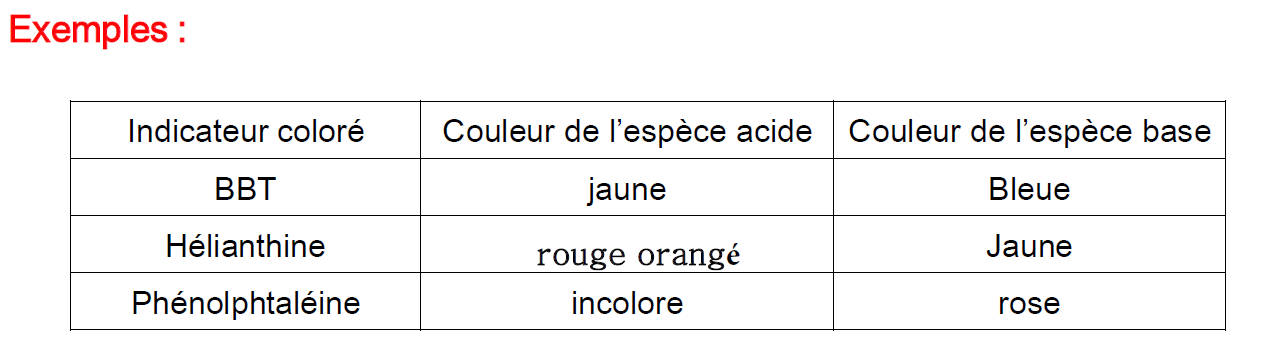
Exemples:
| Indicateur coloré | Couleur de l’espèce acide | Couleur de l’espèce base |
| BBT | jaune | bleue |
| Hélianthine | rouge orangé | Jaune |
| Phénolphtaléine | incolore | rose |
Exemples de couple acido-basique:
| demi-équation | L’acide | sa base conjuguée | couple acido-basique |
| $\mathrm{CH}_3 \mathrm{COOH} \rightleftarrows \mathrm{CH}_3 \mathrm{COO}^{-}+\mathrm{H}^{+}$ | $\mathrm{CH}_3 \mathrm{COOH}$ | $$ \mathrm{CH}_3 \mathrm{COO}^{-} $$ | $\mathrm{CH}_3 \mathrm{COOH} / \mathrm{CH}_3 \mathrm{COO}^{-}$ |
| $\mathrm{HNO}_3 \rightleftarrows \mathrm{NO}_3^{-}+\mathrm{H}^{+}$ | $\mathrm{HNO}_3$ | $\mathrm{NO}_3^{-}$ | $\mathrm{HNO}_3 / \mathrm{NO}_3^{-}$ |
| $\mathrm{NH}_4^{+} \rightleftarrows \mathrm{NH}_3+\mathrm{H}^{+}$ | $\mathrm{NH}_4{ }^{+}$ | $\mathrm{NH}_3$ | $\mathrm{NH}_4{ }^{+} / \mathrm{NH}_3$ |
| $\mathrm{HCOOH} \rightleftarrows \mathrm{HCOO}^{-}+\mathrm{H}^{+}$ | $\mathrm{HCOOH}$ | $\mathrm{HCOO}^{-}$ | $\mathrm{HCOOH} / \mathrm{HCOO}^{-}$ |
| $\mathrm{H}_3 \mathrm{O}^{+} \rightleftarrows \mathrm{H}_2 \mathrm{O}+\mathrm{H}^{+}$ | $\mathrm{H}_3 \mathrm{O}^{+}$ | $\mathrm{H}_2 \mathrm{O}$ | $\mathrm{H}_3 \mathrm{O}^{+} / \mathrm{H}_2 \mathrm{O}$ |
| $H I n \rightleftarrows \mathrm{In}^{-}+\mathrm{H}^{+}$ | $$ \text { HIn } $$ | $\mathrm{In}^{-}$ | $\mathrm{HIn} / \mathrm{In}^{-}$ |