Suivie temporel d’une réaction – vitesse volumique
I. Le suivi temporel d'une transformation chimique
Effectuer un suivi temporel d’une transformation chimique, c’est connaître la composition du mélange réactionnel à chaque instant c.à.d déterminer la valeur de l’avancement de la de la réaction à chaque instant $t$.
1) Méthodes utilisées pour suivre l’évolution d’une transformation
$$
\begin{array}{|c|c|c|c|c|}
\hline \begin{array}{c}
\text { En fonction de } \\
\text { la masse } m
\end{array} & \begin{array}{c}
\text { En fonction de volume } \\
\text { de gaz } V_{g a z}
\end{array} & \begin{array}{c}
\text { En fonction de } \\
\text { la pression } P
\end{array} & \begin{array}{c}
\text { En fonction de } \\
\text { concentration } C
\end{array} & \begin{array}{c}
\text { On utilisons la } \\
\text { conductivité } \sigma
\end{array} \\
\hline n=\frac{m}{M} & n=\frac{V}{V_m} & n=\frac{P \cdot V}{R . T} & n=C \cdot V & \sigma=\sum \lambda_i \cdot\left[X_i\right] \\
\hline
\end{array}
$$
a- Méthode chimique :
le titrage (méthode destructive) le dosage permet de déterminer la concentration ou la quantité de matière d’un produit ou d’un réactif.
b- Méthodes physiques (ne perturbent pas le milieu réactionnel)
On peut déterminer la quantité de matière d’un réactif ou d’un produit en utilisant une grandeur physique mesurable.
* La conductance : si le mélange réactionnel contient des ions actifs
* Le pH : si le mélange réactionnel contient des ions $\mathrm{H}_3 \mathrm{O}^{+}$ou $\mathrm{HO}^{-}$.
* Le volume d’un gaz si la pression reste constante.
* La pression d’un gaz si le volume reste constant.
* La masse si on a un solide.
2) Tableau d’avancement et l’avancement maximal.
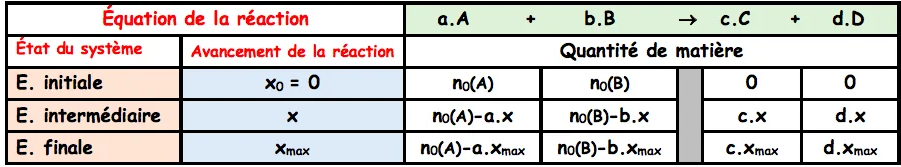
• Si $A$ est limitant, on a $n_0(A)-a \cdot x_{\max }=0 \Rightarrow x_{\max 1}=n_0(A) / a$.
•Si B est limitant, on a $n_0(B)-b . x_{\max }=0 \Rightarrow x_{\max 2}=n_0(B) / b$.
L’avancement maximale correspond à la valeur minimale obtenue de $X_{\max 1}$ et $X_{\max 2}$.
II. Vitesse volumique de réaction
1) Définition :
La vitesse volumique d’une réaction à un instant $t$ est égale à la dérivée de l’avancement $x(t)$, par rapport au temps, divisée par le volume $V_S$ du mélange réactionnel.
$$
v\left(t^{\prime}\right)=\frac{1}{V s}\left(\frac{d x}{d t}\right)_t \quad \text { exprimée en }\left(\mathrm{mol} . \mathrm{L}^{-1} \mathrm{~s}^{-1}\right)
$$
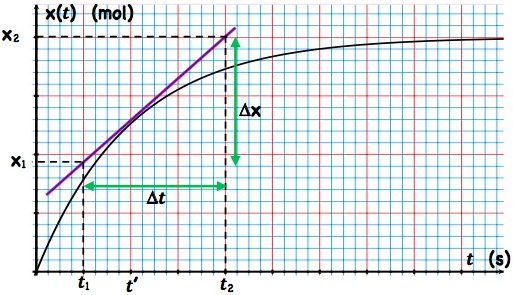
2) Méthode de détermination graphique de $v$ :
Graphiquement, $\left(\frac{d x}{d t}\right)_{t^{\prime}}$ est le coefficient directeur de la tangente à la courbe de la fonction $x(t)$ à la date $t^{\prime}$.
• On trace la tangente à la courbe à la date $t^{\prime}$ choisie.
• On calcule le coefficient directeur de cette tangente. $\left.\frac{d x}{d t}\right)+^{\prime}=\frac{\mathrm{x}\left(\mathrm{t}_2\right)-\mathrm{x}\left(\mathrm{t}_1\right)}{\mathrm{t}_2-\mathrm{t}_1}$
• On multiplie ce coefficient par $\frac{1}{V s} \cdot v\left(\boldsymbol{t}^{\prime}\right)=\frac{1}{V_S} \frac{\mathbf{x}\left(\mathrm{t}_2\right)-\mathbf{x}\left(\mathrm{t}_1\right)}{\mathrm{t}_2-\mathrm{t}_1}$
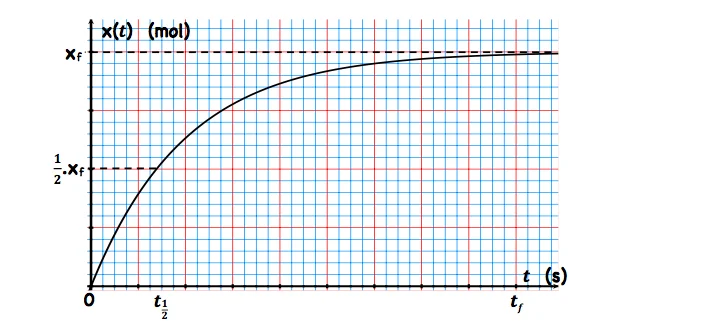
III. Le temps de demi- réaction.
Le temps de demi réaction noté $t_{1 / 2}$ est la durée au bout de laquelle l’avancement $x$ atteint la moitié de sa valeur finale.
$$
x\left(t_{\frac{1}{2}}\right)=\frac{1}{2} x_f
$$
VI. Exemple de suivi cinétique d'une transformation
Quiz Summary
0 of 14 Questions completed
Questions:
Information
You have already completed the quiz before. Hence you can not start it again.
Quiz is loading…
You must sign in or sign up to start the quiz.
Vous devez d’abord complété le suivant :
Résultats
Résultats
0 of 14 Questions answered correctly
Your time:
Temps écoulé
You have reached 0 of 0 point(s), (0)
Earned Point(s): 0 of 0, (0)
0 Essay(s) Pending (Possible Point(s): 0)
Catégories
- Pas classé 0%
- Révision
- Répondu
- Exact
- Inexact
-
Question 1 of 14
1. Question
-
Question 2 of 14
2. Question
-
Question 3 of 14
3. Question
-
Question 4 of 14
4. Question
-
Question 5 of 14
5. Question
-
Question 6 of 14
6. Question
-
Question 7 of 14
7. Question
-
Question 8 of 14
8. Question
-
Question 9 of 14
9. Question
-
Question 10 of 14
10. Question
-
Question 11 of 14
11. Question
-
Question 12 of 14
12. Question
-
Question 13 of 14
13. Question
-
Question 14 of 14
14. Question