Réactions lentes et réactions rapides
I. Introduction
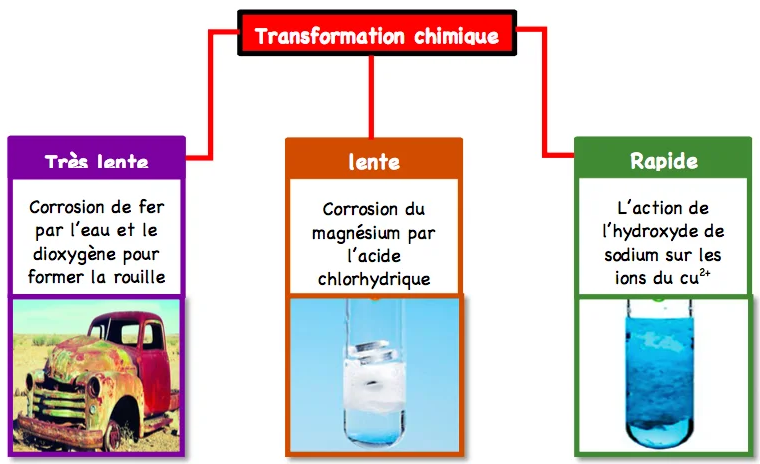
II.Transformation rapide
1) Définition
On dit qu’une transformation est rapide si elle se fait en une durée trop courte pour que son évolution puisse être suivie « à l’œeil nu » ou avec les appareils de mesure courants. C’est-à-dire qu’il est impossible de distinguer les états intermédiaires entre l’état initial et l’état final du système.
2) Exemple :
* $\mathrm{I}_2+2 \mathrm{~S}_2 \mathrm{O}_3{ }^{2-} \rightarrow 2 \mathrm{I}^{-}+\mathrm{S}_4 \mathrm{O}_6{ }^{2-}$. Disparition instantanée de la couleur de $\mathrm{I}_2$.
\& Les réactions de précipitations : $\mathrm{Zn}^{2+}+2 \mathrm{OH}^{-} \rightarrow \mathrm{Zn}(\mathrm{OH})_2$
* Les réactions de dosage.
III. Transformation lentes
1) Définition
C’est une transformation dont l’évolution peut être suivie « à I’oeil nu » ou avec les appareils de mesure courants pendant quelques secondes (ou plus longtemps).
2) Exemple
a. Réaction des ions iodure avec l’eau oxygénée (peroxyde d’hydrogène).
Les couples $\mathrm{H}_2 \mathrm{O}_2 / \mathrm{H}_2 \mathrm{O}$ et $\mathrm{I}_2 / \mathrm{I}^{-}$
$$
\mathrm{H}_2 \mathrm{O}_{2(\mathrm{qq)}}+2 \mathrm{I}_{-(\mathrm{qq)}}+2 \mathrm{H}_{(a q)}^{+} \rightarrow I \mathrm{I}_{2(\mathrm{qq)}}+2 \mathrm{H}_2 \mathrm{O}_{(\mathrm{L})}
$$
L’apparition du diiode est progressive comme en témoigne la coloration progressive de la solution.

b. La dismutation des ions thiosulfate.
la réaction entre les ions thiosulfate en milieu acide conduit à la formation progressive du soufre qui rend la solution opaque.
Les couples ox/red : $\mathrm{SO}_2 / \mathrm{S}_2 \mathrm{O}_3{ }^{2-}$ et $\mathrm{S}_2 \mathrm{O}_3{ }^{2-} / \mathrm{S}$
$$
\begin{gathered}
\mathrm{S}_2 \mathrm{O}_3^{2-}+6 \mathrm{H}^{+}+4 e^{-} \rightarrow 2 \mathrm{~S}+3 \mathrm{H}_2 \mathrm{O} \\
\mathrm{~S}_2 \mathrm{O}_3^{2-}+\mathrm{H}_2 \mathrm{O} \rightarrow 2 \mathrm{SO}_2+2 \mathrm{H}^{+}+4 \mathrm{e}^{-} \\
\hline 2 \mathrm{~S}_2 \mathrm{O}_3^{2-}+4 \mathrm{H}^{+} \rightarrow 2 \mathrm{~S}+2 \mathrm{SO}_2+2 \mathrm{H}_2 \mathrm{O}
\end{gathered}
$$

VI. Facteurs cinétiques
1) Définition
Un facteur cinétique est un facteur qui influe sur la durée d’une transformation chimique (qui modifie la vitesse d’évolution d’une transformation chimique).
2) Les facteurs cinétiques.
a) La température :
Soit la réaction lente suivante : $2 . \mathrm{S}_2 \mathrm{O}_8{ }^{2-}+2 . \mathrm{I}^{-} \rightarrow 2 . \mathrm{SO}_4{ }^{2-}+\mathrm{I}_2$
✹ Expérience :
Les béchers $A$ et $B$ contient deux solutions d’iodure de potassium ( $\mathrm{K}^{+}+\mathrm{I}^{-}$) de même concentrations $C_1$.
Les béchers $C$ et $D$ contient deux solutions de peroxodisulfate de sodium ( $2 \mathrm{Na}^{+}+\mathrm{S}_2 \mathrm{O}_8{ }^{2-}$ ) de même concentrations $C_2$.
On verser simultanément le contenu du bécher $A$ dans $C$ et celui de $B$ dans $D$ et on maintient le mélange $(A+C)$ à $40^{\circ} \mathrm{C}$ et le mélange $(B+D)$ à $20^{\circ} \mathrm{C}$.
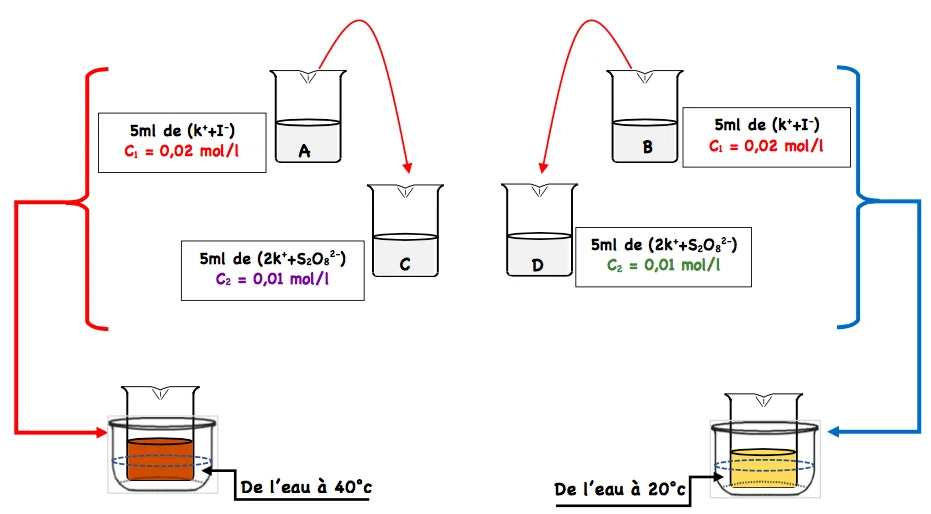
✹Observation
On constate que l'apparition de la couleur brune de $I_2$ est plus rapide dans le mélange $(A+C)$ que dans le mélange( $B+D$ ).
✹Conclusion
Plus la concentration initiale des réactifs est élevée,plus la durée de transformation est courte donc plus la réaction est rapide.
c)La catalyse
✹ Définition
Un catalyseur est une espèce qui diminue la durée de réaction dans le milieux réactionnel où il est introduit sans figurer dans l'équation de la réaction.
✹ Exemple :La réaction de décomposition(dismutation)de l'eau oxygénée(ou peroxyde d'hydrogène: $\mathrm{H}_2 \mathrm{O}_2$ )peut être catalysée par les ions fer(III)en solution aqueuse.
$$
2 \mathrm{H}_2 \mathrm{O}_2 \xrightarrow{\mathrm{Fe} 3+} 2 \mathrm{O}_2+2 \mathrm{H}_2 \mathrm{O}
$$
1- Écrire l’équation de la réaction d’oxydoréduction entre les ions du permanganate et des ions de fer (II) en milieu acide. On donne les couples: $\mathrm{Fe}^{3+} / \mathrm{Fe}^{2+}$ et $\mathrm{MnO}_4^{-} / \mathrm{Mn}^{2+}$
2- Dans un milieu acide l’eau oxygénée réagit avec les ions iodures, les couples mis en jeu : $\mathrm{I}_2 / \mathrm{I}$ $\mathrm{H}_2 \mathrm{O}_2 / \mathrm{H}_2 \mathrm{O}$. Écrire l’équation bilan de cette réaction.