Réaction s’effectuant dans les deux sens
I. Rappels sur les acides et les bases.
1) Acide et base celons Bronchted
L’acide celons Bronchted est une espèce chimique capable de libérer un proton.
La base celons Bronchted est une espèce chimique capable de fixer un proton.
$$
\mathrm{AH} \leftrightarrows \mathrm{~A}^{-}+\mathrm{H}^{+} \quad \text { et } \quad \mathrm{B}+\mathrm{H}^{+} \leftrightarrows \mathrm{BH}^{+}
$$
$A H$ et $A^{-}$forme un couple acide base. $A H / A^{-}$
2) réaction acide – base
Dans une réaction acide – base il y a échange de protons entre l’acide d’un couple et la base d’un autre couple
$$
A_1 H+A_2^{-} \rightarrow A_1^{-}+A_2 H
$$
II. Le pH et sa mesure.
Le caractère acide d’une solution aqueuse est dû à la présence des ions oxonium $\mathrm{H}_3 \mathrm{O}^{+}$ dans cette solution.
1) Définition du pH.
Le pH , grandeur sans dimension (sans unité) qui mesure l’acidité d’une solution aqueuse diluée, est défini par la relation:
$$
\mathrm{PH}=-\log \left(\left[\mathrm{H}_3 \mathrm{O}^{+}\right]\right)
$$
La concentration en ions oxonium est exprimé en mol. $\mathrm{L}^{-1}$.
Inversement la connaissance de la valeur du pH d’une solution nous permet de déterminer la concentration en ions oxonium :
$$
\left[\mathrm{H}_3 \mathrm{O}^{+}\right]=10^{-\mathrm{pH}}
$$
La fonction logarithme est une fonction croissante donc Plus $\left[\mathrm{H}_3 \mathrm{O}^{+}\right]$est grand plus le PH est petit plus la solution est acide.
2) Mesure du PH.
 Le pH se mesure à l’aide d’un pH -mètre.
Le pH se mesure à l’aide d’un pH -mètre.
On peut aussi utiliser le papier PH , mais il donne des valeurs moins précises.
papier PH , mais il donne des valeurs moins précises.
III. Transformation chimique totale et limitée.
1) Réaction du chlorure d’hydrogène HCl avec l’eau.
a. L’observation expérimentale.
Le pH d’une solution aqueuse d’acide chlorhydrique de concentration molaire $C=1,0.10^{-2} \mathrm{~mol} . \mathrm{L}^{-1}$ est égal $\mathrm{PH}=2,0$ à $25^{\circ} \mathrm{C}$
b. Interprétation.
Considérons un volume $V$ de solution.
le tableau d’avancement de la réaction du chlorure d’hydrogène avec l’eau:
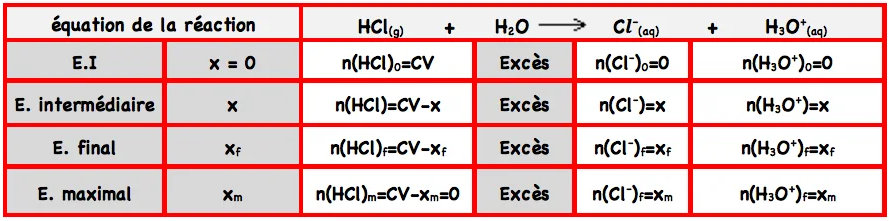
⊹ $x_m$ est l’avancement maximum, on le détermine d’une façon théorique (on considérant le réactif limitant)
⊹ $x_f$ est l’avancement final , on le détermine par une mesure expérimentale
$$
\left.\begin{array}{llr}
\text { On a : }\left[\mathrm{H}_3 \mathrm{O}^{+}\right]_f=\frac{x_f}{\mathrm{~V}}=10^{-\mathrm{PH}} & \Rightarrow & x_f=10^{-\mathrm{PH}} \cdot \mathrm{~V}=10^{-2} \mathrm{~V} \\
\mathrm{HCl} \text { est le réactif limitant } & \Rightarrow & x_m=C V=10^{-2} \mathrm{~V}
\end{array}\right\} x_f=x_m
$$
Donc: $\quad n_f(H C l)=C . V-x_f=x_m-x_f=0$; tout le chlorure d’hydrogène a réagi avec l’eau, La réaction est totale.
2) Réaction de l’acide éthanoïque avec l’eau.
a. Observation expérimentale.
Le pH d’une solution d’acide éthanoïque de concentration $C=1,0 \cdot 10^{-2} \mathrm{~mol} . \mathrm{L}^{-1}$ à $25^{\circ} \mathrm{C}$ est égal à 3,4 .
b. Interprétation.
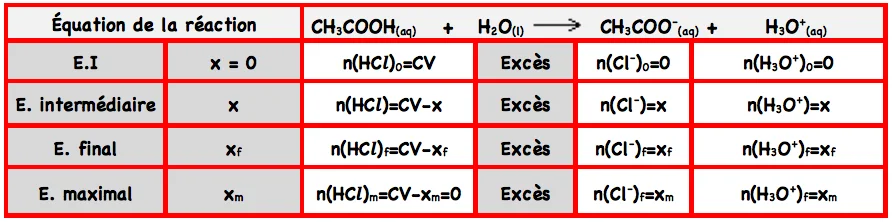
Considérons un volume V de solution.Le tableau d’avancement de la réaction entre l’acide éthanoïque et l’eau est:
$$
\left.\begin{array}{ccr}
{\left[\mathrm{H}_3 \mathrm{O}^{+}\right]_{\mathrm{f}}=\frac{\mathrm{x}_{\mathrm{f}}}{\mathrm{~V}}=10^{-\mathrm{PH}}} & \Rightarrow & x_f=10^{-\mathrm{PH}} \cdot \mathrm{~V}=10^{-3,4} \mathrm{~V} \\
C \mathrm{H}_3 \mathrm{COOH} \text { est le réactif limitant } & \Rightarrow & x_{\mathrm{m}}=\mathrm{CV}=10^{-2} \mathrm{~V}
\end{array}\right\} x_f<x_m
$$
Donc : $\quad n_f\left(\mathrm{CH}_3 C O O H\right)=C V-x_f=x_m-x_f \neq 0$, il en résulte que la réaction n’est pas totale.
C’est une réaction limitée.
IV. Le taux d'avancement final
Le taux d’avancement fínal est le quotient de l’avancement final sur l’avancement maximum.
$$
\tau=\frac{x_f}{x_m}
$$
$$
0<\tau \leq 1
$$
$\tau=1$ pour les réaction totales : $\quad \tau<1$ pour les réactions limitées
pour l’exemple précèdent $\tau=\frac{10^{-P H}}{C}=4 \%$
Remarque
$\tau=4 \%$ veut dire que 4 molécules de $\mathrm{CH}_3 \mathrm{COOH}$ sur 100 molécules ont réagi. ça veut dire aussi que $\left[\mathrm{CH}_3 \mathrm{COO}^{-}\right]=4 \% . \mathrm{C}$ et $\left[\mathrm{CH}_3 \mathrm{COOH}\right]=94 \% . C$.
V. Réaction s'effectuant dans les deux sens.
1) Étude expérimentale.
a. Expérience et observations.
Considérons l’expérience suivante :
On dispose de deux béchers, notés (1) et (2), contenant tous les deux le même volume de la même solution d’acide éthanoïque à la concentration $\mathrm{c}=10^{-2} \mathrm{~mol} . \mathrm{L}^{-1}$ à $25^{\circ} \mathrm{C}$.
Une mesure du pH dans chaque bécher donne $\mathrm{pH}=3,4$.
– Expérience
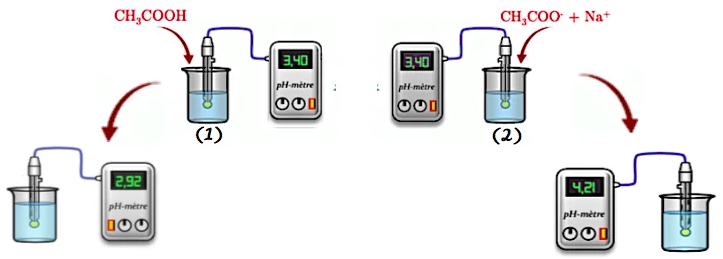
On ajoute alors, dans le bécher (1) quelques gouttes d’acide éthanoïque pur, et dans le bécher (2), quelques cristaux d’éthanoate de sodium (sans changer de volume). Après agitation, le pH dans le bécher (1) devient $\mathrm{PH}_1=2,92$ et dans le bécher (2) $\mathrm{PH}_2=4,21$.
b. Interprétation.
⊹ Dans le bécher (1), le pH diminue (il passe de 3,4 à 2,92 ) donc la concentration des ions oxonium $\mathrm{H}_3 \mathrm{O}^{+}$augmente. Ce qui signifie que la réaction d’équation: $\mathrm{CH}_3 \mathrm{COOH}+\mathrm{H}_2 \mathrm{O} \longrightarrow \mathrm{CH}_3 \mathrm{COO}^{-}+\mathrm{H}_3 \mathrm{O}^{+}$. s’effectue dans le sens direct indiqué par la flèche (sens de production des ions $\mathrm{H}_3 \mathrm{O}^{+}$)
⊹ Dans le bécher (2), le pH augmente (il passe de 3,4 à 4,21) donc la concentration des ions oxonium $\mathrm{H}_3 \mathrm{O}^{+}$diminue. Ce qui signifie que la réaction précédente s’effectue dans le sens inverse de celui indiqué par la flèche (sens de disparition des ions $\mathrm{H}_3 \mathrm{O}^{+}$). $\quad \mathrm{CH}_3 \mathrm{COOH}+\mathrm{H}_2 \mathrm{O} \leftarrow \mathrm{CH}_3 \mathrm{COO}^{-}+\mathrm{H}_3 \mathrm{O}^{+}$.
⊹ Lorsqu’une transformation chimique n’est pas totale, la réaction qui lui est associée peut s’effectuer dans les deux sens, on appelée : Réaction réversible on l’exprime par l’écriture suivante
$$
\mathrm{CH}_3 \mathrm{COOH}+\mathrm{H}_2 \mathrm{O} \leftrightharpoons \mathrm{CH}_3 \mathrm{COO}^{-}+\mathrm{H}_3 \mathrm{O}^{+}
$$
et l’état final de cette réaction est appelé état d’équilibre.
2) Étude microscopique de l’état d’équilibre
À l’état final d’une transformation limitée, le système cesse d’évoluer et les concentrations des réactifs et des produits restent alors constantes. Au niveau microscopique la réaction se fait dans le deux sens à la même vitesse $\left(v_1=v_2\right)$. On dit aussi que le système en équilibre dynamique.
1. Calculer la valeur de pH des solutions suivantes:
$$
\left[\mathrm{H}_3 \mathrm{O}^{+}\right]_1=1,2.10^{-3} \mathrm{~mol} . \mathrm{L}^{-1} ;\left[\mathrm{H}_3 \mathrm{O}^{+}\right]_2=1,0.10^{-5} \mathrm{mmol} . \mathrm{L}^{-1} ;\left[\mathrm{H}_3 \mathrm{O}^{+}\right]_3=0,080 \mathrm{~mol} . \mathrm{m}^{-3}
$$
2. Calculer la concentration des ions $\mathrm{H}_3 \mathrm{O}^{+}$dans les solutions suivantes: $\mathrm{pH}_1=5,02, \mathrm{pH}_2=8,3$
Exercice
On détermine, à $25^{\circ} \mathrm{c}$, la conductivité des solutions d’acide fluorhydrique HF de concentrations c différentes. es résultats sont donnés dans le tableau ci-après:
\begin{tabular}{|l|c|c|c|}
\hline \multicolumn{1}{|c|}{$C \mathrm{~mol} / \mathrm{L}$} & $10^{-2}$ & $10^{-3}$ & $10^{-4}$ \\
\hline$\sigma \mathrm{~S} / \mathrm{m}$ & $9,00 \cdot 10^{-2}$ & $2,185 \cdot 10^{-2}$ & $3,567 \cdot 10^{-3}$ \\
\hline
\end{tabular}
1/ Écrire l’équation de réaction du fluorure d’hydrogène avec l’eau.
2/ Déterminer la concentration effective des ions $\mathrm{H}_3 \mathrm{O}^{+}$et $\mathrm{F}^{-}$de ces diverses solutions.
3/ Déduire le PH de chaque solution.
4/ Calculer le taux d’avancement de la réaction du fluorure d’hydrogène avec l’eau pour chacune des solutions.
5/ Comment varie ce taux d’avancement avec la dilution de la solution ?
On donne : $\lambda\left(\mathrm{H}_3 \mathrm{O}^{+}\right)=35 \mathrm{mS} \cdot \mathrm{m}^2 \cdot \mathrm{~mol}^{-1}, \lambda\left(\mathrm{~F}^{-}\right)=5,54 \mathrm{mS} . \mathrm{m}^2 \cdot \mathrm{~mol}^{-1}$.